
插图 作者:McCall Sarrett
无论是忘记20多年的生活,还是每五分钟进行一次相同的谈话,每次都忘记它,记忆力受损会对日常生活造成很大的影响。 它可能是神经退行性疾病最令人困惑的方面之一,也是痴呆症的一个关键症状。
阿尔茨海默症,也被称为 AD,是最常见的痴呆症,以认知困难和记忆力减退为特征。 除了尸检之外,目前还没有用于诊断AD的官方临床技术。 然而,阿尔茨海默病患者的脑组织有两个特征: β淀粉样蛋白 (A?) 斑块和神经原纤维缠结,这两者都提供了对神经变性病理学的大量了解。
“神经原纤维缠结是由蛋白质缺陷引起的,称为tau蛋白。”
A?是一种蛋白质,源自 蛋白水解 of 淀粉样蛋白前体蛋白 (APP)。这意味着APP被切割成更小的碎片,其中之一就是A?分段。 APP 被称为分泌酶的酶切成这些片段,其主要作用是裂解这些蛋白质。存在多种分泌酶,但有一种对阿尔茨海默病的病理学具有重要意义——γ分泌酶。 γ分泌酶产生一种特殊形式的Aβ:Aβ-42,这是该蛋白质毒性最强的形式。一旦分解,这些蛋白质片段开始聚集在细胞外的空间中。这些蛋白质毒性的关键在于它们具有“粘性”特征,因此它们开始形成聚集体。这些聚集体继续发展,很快这些淀粉样蛋白斑块就无处不在,极大地损害了神经元功能。
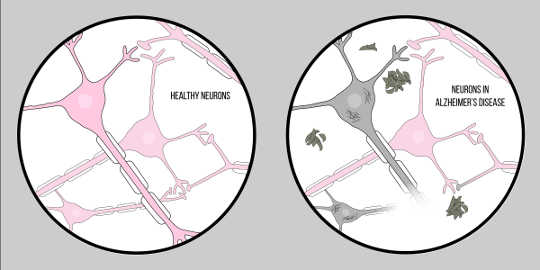 图片来自McCall Sarrett
图片来自McCall Sarrett
这对A的影响?对神经功能的影响导致 淀粉样蛋白假说,一个公认的理论,提出阿尔茨海默氏症神经变性的解释。
现在,对于第二个关键特征:神经原纤维缠结。 神经原纤维缠结起因于称为tau蛋白的蛋白质缺陷。 Tau蛋白作为细胞内称为微管的结构之间的桥梁。 微管是支持分子,其为细胞,特别是轴突提供形状和结构。 Tau蛋白帮助这些微管为轴突提供结构。 但是,在这种情况下 阿尔茨海默氏病一种以神经元丢失为特征的神经退行性疾病...,tau蛋白在细胞体内分离并积聚,也称为体细胞。 这会导致轴突退化,使神经元更难沟通。 神经元通讯的这种困难类似于β淀粉样蛋白的作用; 然而,重要的是要注意这些缠结与前面讨论的斑块差别很大,因为它们影响来自细胞内部而不是外部的通信。
“科学家们仍然不确定阿尔茨海默病病理学的确切机制。”
虽然两者都极具影响力,但A?和 tau 蛋白并不是与阿尔茨海默病病理学相关的唯一因素。研究表明,载脂蛋白 E (APOE) 基因 可能和A一样有影响力。编码蛋白质的主要变体有 2 种:ApoE3、ApoE4 和 ApoE4。 ApoE2 已被证明与突触修剪的减少相关,而 ApoEXNUMX 则导致突触修剪的增加。两种形式都有影响 星形胶质细胞 (重要 胶质细胞 在神经系统内)并与它们的吞噬率相关,这是一个过程 星形胶质细胞星形神经胶质细胞具有许多功能,包括细胞物质。 每种ApoE变体直接影响这种吞噬作用的速率ApoE2,导致增加,ApoE4减少。 这表明当与ApoE4相关时,星形胶质细胞可能不太能够“清除”漂浮在细胞周围的碎片。 因此,当这些斑块累积时,ApoE4基因型可以防止这些聚集体的清除,从而导致变性。
淀粉样蛋白β,tau和各种基因共同作用导致细胞之间的主要沟通问题,这基本上就是我们所知的阿尔茨海默病。 这种神经变性最常见于与学习和记忆相关的大脑区域,但最终会扩散到整个大脑。 由于缺乏沟通,会导致突触丢失,最终导致大脑物质减少。 因此,看到脑组织减少是正常的 MRI磁共振成像,一种观察结构的技术...随着疾病的进展,揭示出阿尔茨海默氏症会使大脑缩小。 我们目前的学习和记忆模型表明,突触在这些过程中发挥关键作用,为这种病理如何与AD的主要症状(如记忆丧失)相关联提供了可能的解释。
科学家们仍然不确定阿尔茨海默病病理学的确切机制。 已经研究了许多创新方法以试图进一步了解这种病理学点,一种是脑脊液(CSF)生物标志物。
A 的等级? tau 蛋白可以通过腰椎穿刺收集脑脊液来测量脑脊液中的 tau 蛋白。 tau 水平升高而 A 水平降低?见于阿尔茨海默病患者。这是A的结果?大脑中的积累,进而导致脑脊液中的浓度降低。这些数据表明,未来医生和科学家或许能够通过检查脑脊液中的蛋白质水平来预测患者的认知状态。
目前,阿尔茨海默病尚无明确的治愈方法。 然而,对所涉及的病理蛋白,相关基因和正在进行的科学研究的了解不断增加,为未来的有效治疗提供了希望。
您认为药物需要什么突破才能实现阿尔茨海默氏症的治疗? 让我们在评论中知道!
这篇文章最初出现在 了解神经元?
关于作者
Khayla Black是纽约大学上海分校的一名新生,他计划申请神经科学专业,主修数据科学,专注于人工智能。 在未来,她希望获得MD / PhD并成为一名神经科学家,研究学习和记忆的分子方面。 在业余时间,Khayla喜欢在IYNA内部开展MYELIN计划以及阅读任何神经科学相关材料。 在学习神经科学之外,她喜欢跑步,在当地小学教书,解决数学问题,以及喝大量的咖啡。
相关书籍
at InnerSelf 市场和亚马逊
参考资料
拉科尔,PN,布尼尔,MC,弗洛,PW,克莱门特,AS,贝拉斯科,PT,伍德,M.,。 。 。克莱因,WL(2007 年,24 月 XNUMX 日)。 A?低聚物引起的畸变 突触 成分,形状和密度为阿尔茨海默病的连接丧失提供了分子基础。 从...获得 http://www.jneurosci.org/content/27/4/796
墨菲议员和莱文 H. (2010)。阿尔茨海默病和β-淀粉样肽。 阿尔茨海默病杂志?:JAD, 19(1),311。 http://doi.org/10.3233/JAD-2010-1221
O'Brien,RJ和Wong,PC(2011)。 淀粉样前体蛋白加工和阿尔茨海默氏病。 神经科学年度回顾, 34,185-204。 http://doi.org/10.1146/annurev-neuro-061010-113613
Chung,W.-S.,Verghese,PB,Chakraborty,C.,Joung,J.,Hyman,BT,Ulrich,JD,... Barres,BA(2016)。 新的等位基因依赖的APOE控制率的作用 突触信号传递的神经元之间的连接......星形胶质细胞修剪。 美国“国家科学院的诉讼中, 113(36),10186-10191。 http://doi.org/10.1073/pnas.1609896113
Zetterberg, H.(2009 年,19 月 XNUMX 日)。淀粉样蛋白?和 APP 作为阿尔茨海默病的生物标志物。从...获得 https://www.sciencedirect.com/science/article/pii/S0531556509001594?via=ihub























